jueves, 25 de junio de 2009
John Dalton
Biografía
Nació en el seno de una familia pobre de tejedores cuáqueros devotos. Con 12 años, en 1778, comenzó a impartir enseñanza elemental en Cumberland, y a partir de 1780 lo hizo en Kendal durante 12 años más.
En 1792, a la edad de 26 años se trasladó a Manchester, donde impartió matemática y filosofía natural en el New College.
En 1793 inició estudios sobre meteorología, recopilando a lo largo de su vida más de 200.000 anotaciones, y ese mismo año publicó Observaciones y Ensayos de Meteorología. En sus estudios sobre la meteorología desarrolló varios instrumentos de medición y propuso por primera vez que el origen de la lluvia se encuentra en el descenso de la temperatura. En este ámbito estudió también las auroras boreales, y determinó que éstas están relacionadas con el magnetismo de la Tierra.
Estudió la enfermedad que padecía, conocida como acromatopsia y posteriormente llamada daltonismo en su honor, y publicó hechos extraordinarios relativos a la Visión de Colores (1794).
A partir de 1800 pasó a la enseñanza privada y ocupó el cargo de secretario de la Sociedad Filosófica y Literaria de Manchester, que presidió a partir de 1817.
Fue alumno suyo el también físico James Prescott Joule, que más tarde efectuó estudios sobre magnetismo y que puso las bases para el desarrollo de las leyes sobre la conservación de la energía (termodinámica).
En 1801 enunció la ley de las presiones parciales y la de las proporciones múltiples.
En 1808 expuso la teoría atómica en la que se basa la ciencia física moderna. Demuestra que la materia se compone de partículas indivisibles llamadas átomos. También ideó una escala de símbolos químicos, que serán luego reemplazadas por la escala de Berzelius.
En 1826 se le concedió la Medalla de Oro de la Royal Society de Londres, así como de la Academia Francesa de las Ciencias.
Falleció en Manchester en 1844, a la edad de 78 años. Más de 40.000 personas acudieron al funeral para presentar sus respetos al científico.
Teoría de Dalton
Dalton tomo como punto de partida una serie de evidencias experimentales conocidas en su época:
Las sustancias elementales no pueden descomponerse.
Las sustancias, simples o compuestas, tienen siempre las mismas propiedades características.
Los elementos no desaparecen al formarse un compuesto, pues se pueden recuperar por descomposición de éste.
La masa se conserva en las reacciones químicas, que provenía de la Ley de conservación de la masa del químico francés Lavoisier.
La proporción de los elementos que forman un compuesto es constante, que provenía de la Ley de las proporciones definidas del también químico francés Proust.
Para explicar estos hechos propuso las siguientes hipótesis:
La masa es discontinua; esta formada por átomos que son particulas indivisibles.
Todos los átomos de un mismo elemento son iguales, tienen la misma masa y átomos de diferentes elementos difieren en su masa.
Los átomos de diferentes elementos se combinan para formar "átomos compuestos".
Los cambios químicos son cambios en las combinaciones de los átomos entre si, los átomos no se crean ni se destruyen
Los átomos que se combinan para formar un compuesto lo hacen siempre en la misma proporción, es decir, que todos los "átomos compuestos" de una misma sustancia son iguales, que será la Ley de las proporciones múltiples.
La contribución de Dalton no fue proponer una idea asombrosamente original, sino formular claramente una serie de hipótesis.
Los errores de Dalton por culpa del daltonismo
La ceguera a ciertos colores que padecía, conocida hoy como daltonismo, le jugó más de alguna mala pasada a este científico. Al momento de experimentar sus teorías en el laboratorio, pocas veces pudo comprobarlas porque confundía los frascos de reactivos. Sin embargo, continuaba firme defendiendo sus ideas en el papel.
Otra muestra de esta ceguera que le acompañó toda su vida ocurrió en 1832, cuando fue a conocer al rey Guillermo IV y lució una vestimenta académica escarlata (rojo), un color nada habitual para un hombre de su discreción. La razón: él la veía de color gris oscuro por lo que poco le importó la sorpresa que ese día causó entre sus conocidos. Dalton descubrió que tenía esta afección porque a la hora de experimentar sus teorías confundía los frascos de reactivos. Así, el daltonismo fue descrito por primera vez por John Dalton en 1808. Él, al igual que su hermano, sufría de este error genético que en términos simples le impide identificar colores como el rojo y el verde.
miércoles, 24 de junio de 2009
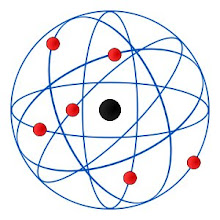
Atomo
El concepto de átomo como bloque básico e indivisible que compone la materia del universo ya fue postulado por la escuela atomista en la Antigua Grecia. Sin embargo, su existencia no quedó demostrada hasta el siglo XIX. Con el desarrollo de la física nuclear en el siglo XX se comprobó que el átomo puede subdividirse en partículas más pequeñas.
Estructura atómica
La teoría aceptada hoy es que el átomo se compone de un núcleo de carga positiva formado por protones y neutrones, en conjunto conocidos como nucleón, alrededor del cual se encuentra una nube de electrones de carga negativa.
El núcleo atómico
El núcleo del átomo se encuentra formado por nucleones, los cuales pueden ser de dos clases:
Protones: Partícula de carga eléctrica positiva igual a una carga elemental, y 1,67262 × 10–27 kg y una masa 1837 veces mayor que la del electrón.
Neutrones: Partículas carentes de carga eléctrica y una masa un poco mayor que la del protón (1,67493 × 10–27 kg)
El núcleo más sencillo es el del hidrógeno, formado únicamente por un protón. El núcleo del siguiente elemento en la tabla periódica, el helio, se encuentra formado por dos protones y dos neutrones. La cantidad de protones contenidas en el núcleo del átomo se conoce como número atómico, el cual se representa por la letra Z y se escribe en la parte inferior izquierda del símbolo químico. Es el que distingue a un elemento químico de otro. Según lo descrito anteriormente, el número atómico del hidrógeno es 1 (1H), y el del helio, 2 (2He).
La cantidad total de nucleones que contiene un átomo se conoce como número másico, representado por la letra A y escrito en la parte superior izquierda del símbolo químico. Para los ejemplos dados anteriormente, el número másico del hidrógeno es 1(1H), y el del helio, 4(4He).
Existen también átomos que tienen el mismo número atómico, pero diferente número másico, los cuales se conocen como isótopos. Por ejemplo, existen tres isótopos naturales del hidrógeno, el protio (1H), el deuterio (2H) y el tritio (3H). Todos poseen las mismas propiedades químicas del hidrógeno, y pueden ser diferenciados únicamente por ciertas propiedades físicas.
Otros términos menos utilizados relacionados con la estructura nuclear son los isótonos, que son átomos con el mismo número de neutrones. Los isóbaros son átomos que tienen el mismo número másico.
Debido a que los protones tienen cargas positivas se deberían repeler entre sí, sin embargo, el núcleo del átomo mantiene su cohesión debido a la existencia de otra fuerza de mayor magnitud, aunque de menor alcance conocida como la interacción nuclear fuerte.
Interacciones eléctricas entre protones y electrones
Antes del experimento de Rutherford la comunidad científica aceptaba el modelo atómico de Thomson, situación que varió después de la experiencia de Rutherford. Los modelos posteriores se basan en una estructura de los átomos con una masa central cargada positivamente rodeada de una nube de carga negativa.
Este tipo de estructura del átomo llevó a Rutherford a proponer su modelo en que los electrones se moverían alrededor del núcleo en órbitas. Este modelo tiene una dificultad proveniente del hecho de que una partícula cargada acelerada, como sería necesario para mantenerse en órbita, radiaria radiación electromagnética, perdiendo energía. Las leyes de Newton, junto con la ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10−10 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.
Nube electrónica
Alrededor del núcleo se encuentran los electrones que son partículas elementales de carga negativa igual a una carga elemental y con una masa de 9,10 × 10–31 kg
La cantidad de electrones de un átomo en su estado basal es igual a la cantidad de protones que contiene en el núcleo, es decir, al número atómico, por lo que un átomo en estas condiciones tiene una carga eléctrica neta igual a 0.
A diferencia de los nucleones, un átomo puede perder o adquirir algunos de sus electrones sin modificar su identidad química, transformándose en un ion, una partícula con carga neta diferente de cero.
El concepto de que los electrones se encuentran en órbitas satelitales alrededor del núcleo se ha abandonado en favor de la concepción de una nube de electrones deslocalizados o difusos en el espacio, el cual representa mejor el comportamiento de los electrones descrito por la mecánica cuántica únicamente como funciones de densidad de probabilidad de encontrar un electrón en una región finita de espacio alrededor del núcleo.
Dimensiones atómicas
La mayor parte de la masa de un átomo se concentra en el núcleo, formado por los protones y los neutrones, ambos conocidos como nucleones, los cuales son 1836 y 1838 veces más pesados que el electrón respectivamente.
El tamaño o volumen exacto de un átomo es difícil de calcular, ya que las nubes de electrones no cuentan con bordes definidos, pero puede estimarse razonablemente en 1,0586 × 10–10 m, el doble del radio de Bohr para el átomo de hidrógeno. Si esto se compara con el tamaño de un protón, que es la única partícula que compone el núcleo del hidrógeno, que es aproximadamente 1 × 10–15 se ve que el núcleo de un átomo es cerca de 100.000 veces menor que el átomo mismo, y sin embargo, concentra prácticamente el 100% de su masa.
Para efectos de comparación, si un átomo tuviese el tamaño de un estadio, el núcleo sería del tamaño de una canica colocada en el centro, y los electrones, como partículas de polvo agitadas por el viento alrededor de los asientos.
Historia de la teoría atómica
El concepto de átomo existe desde la Antigua Grecia propuesto por los filósofos griegos Demócrito, Leucipo y Epicuro, sin embargo, no se generó el concepto por medio de la experimentación sino como una necesidad filosófica que explicara la realidad, ya que, como proponían estos pensadores, la materia no podía dividirse indefinidamente, por lo que debía existir una unidad o bloque indivisible e indestructible que al combinarse de diferentes formas creara todos los cuerpos macroscópicos que nos rodean.
El siguiente avance significativo se realizó hasta en 1773 el químico francés Antoine-Laurent de Lavoisier postuló su enunciado: "La materia no se crea ni se destruye, simplemente se transforma."; demostrado más tarde por los experimentos del químico inglés John Dalton quien en 1804, luego de medir la masa de los reactivos y productos de una reacción, y concluyó que las sustancias están compuestas de átomos esféricos idénticos para cada elemento, pero diferentes de un elemento a otro.
Luego en 1811 Amedeo Avogadro, físico italiano, postuló que a una temperatura, presión y volumen dados, un gas contiene siempre el mismo número de partículas, sean átomos o moléculas, independientemente de la naturaleza del gas, haciendo al mismo tiempo la hipótesis de que los gases son moléculas poliatómicas con lo que se comenzó a distinguir entre átomos y moléculas.
El químico ruso Dmítri Ivánovich Mendeléyev creó en 1869 una clasificación de los elementos químicos en orden creciente de su masa atómica, remarcando que existía una periodicidad en las propiedades químicas. Este trabajo fue el precursor de la tabla periódica de los elementos como la conocemos actualmente.
La visión moderna de su estructura interna tuvo que esperar hasta el experimento de Rutherford en 1911 y el modelo atómico de Bohr. Posteriores descubrimientos científicos, como la teoría cuántica, y avances tecnológicos, como el microscopio electrónico, han permitido conocer con mayor detalle las propiedades físicas y químicas de los átomos.
Neutrón
Un neutrón es un barión neutro formado por dos quarks down y un quark up. Forma, junto con los protones, los núcleos atómicos. Fuera del núcleo atómico es inestable y tiene una vida media de unos 15 minutos emitiendo un electrón y un antineutrino para convertirse en un protón. Su masa es muy similar a la del protón.
Algunas de sus propiedades:
Masa: mn = 1,675x10-27 kg = 1,008587833 uma
Vida media: tn = 886,7 ± 1,9 s
Momento magnético: mn = -1,9130427 ± 0,0000005 mN
Carga eléctrica: 0 C.
El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos (la única excepción es el hidrógeno), ya que interactúa fuertemente atrayéndose con los protones, pero sin repulsión electrostática.
Historia
Ernest Rutherford propuso por primera vez la existencia del neutrón en 1920, para tratar de explicar que los núcleos no se desintegrasen por la repulsión electromagnética de los protones.En el año 1930, en Alemania,Walther Bothe y H. Becker descubrieron que si las partículas alfa del polonio, dotadas de una gran energía, caían sobre materiales livianos, específicamente berilio, boro ó litio, se producía una radiación particularmente penetrante. En un primer momento se pensó que eran rayos gamma, aunque éstos eran más penetrantes que todos los rayos gammas hasta ese entonces conocidos, y los detalles de los resultados experimentales eran difíciles de interpretar sobre estas bases.
En 1932, en París, Irène Joliot-Curie y Frédéric Joliot mostraron que esta radiación desconocida, al golpear parafina u otros compuestos que contenían hidrógeno, producía protones a una alta energía. Eso no era inconsistente con la suposición de que eran rayos gammas de la radiación, pero un detallado análisis cuantitativo de los datos hizo difícil conciliar la ya mencionada hipótesis.
Finalmente (a finales de 1932) el físico James Chadwick (Físico Inglés), en Inglaterra, realizó una serie de experimentos de los que obtuvo unos resultados que no concordaban con los que predecían las fórmulas físicas: la energía producida por la radiación era muy superior y en los choques no se conservaba el momento. Para explicar tales resultados, era necesario optar por una de las siguientes hipótesis: o bien se aceptaba la no conservación del momento en las colisiones o se afirmaba la naturaleza corpuscular de la radiación. Como la primera hipótesis contradecía las leyes de la física, se optó por la segunda. Con ésta, los resultados obtenidos quedaban explicados pero era necesario aceptar que las partículas que formaban la radiación no tenían carga eléctrica.
Tales partículas tenían una masa muy semejante a la del protón, pero sin carga eléctrica, por lo que se pensó que eran el resultado de la unión de un protón y un electrón formando una especie de dipolo eléctrico. Posteriores experimentos descartaron la idea del dipolo y se conoció la naturaleza de los neutrones.
Fisión nuclear
Los neutrones son fundamentales en las reacciones nucleares: una reacción en cadena se produce cuando un neutrón causa la fisión de un átomo fisible, produciéndose un mayor número de neutrones que causan a su vez otras fisiones. Según esta reacción se produzca de forma controlada o incontrolada se tiene lo siguiente:
Reacción incontrolada: sólo se produce cuando se tiene una cantidad suficiente de combustible nuclear -masa crítica-; fundamento de la bomba nuclear.
Reacción controlada: mediante el uso de un moderador en el reactor nuclear; fundamento del aprovechamiento de la energía nuclear.
Protón
En física, el protón (en griego protón significa primero) es una partícula subatómica con una carga eléctrica elemental positiva (1,602 176 487 × 10–19 culombios) y una masa de 938,272 013 MeV/c2 (1,672 621 637 × 10–27 kg) o, del mismo modo, unas 1836 veces la masa de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse, es decir el que sus partículas pierdan la consistencia que poseen y como tal el átomo.
El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos.
El núcleo del isótopo más común del átomo de hidrógeno (también el átomo estable más simple posible) es un único protón. Los núcleos de otros átomos están compuestos de nucleones unidos por la fuerza nuclear fuerte. El número de protones en el núcleo determina las propiedades químicas del átomo y qué elemento químico es.
Descripción
Los protones están clasificados como bariones y se componen de dos quarks arriba y un quark abajo, los cuales también están unidos por la fuerza nuclear fuerte mediada por gluones. El equivalente en antimateria del protón es el antiprotón, el cual tiene la misma magnitud de carga que el protón, pero de signo contrario.
Debido a que la fuerza electromagnética es muchos órdenes de magnitud más fuerte que la fuerza gravitatoria, la carga del protón debe ser opuesta e igual (en valor absoluto) a la carga del electrón; en caso contrario, la repulsión neta de tener un exceso de carga positiva o negativa causaría un efecto expansivo sensible en el universo, y, asimismo, en cualquier cúmulo de materia (planetas, estrellas, etc.)
Química y bioquímica
En fisica y química, el término protón puede referirse al catión de hidrógeno (H+). En este contexto, un emisor de protones es un ácido, y un receptor de protones una base. Esta especie, H+, es inestable en solución, por lo que siempre se encuentra unida a otros átomos. En soluciones acuosas forma el ion hidronio u oxonio (H3O+), donde el protón está unido de forma covalente a una molécula de agua. En este caso se dice que se encuentra hidratado, pero también pueden existir especies de hidratación superior.
Antiprotón
El antiprotón es la antipartícula del protón. Se conoce también como protón negativo. Se diferencia del protón en que su carga es negativa y en que no forma parte de los núcleos atómicos. El antiprotón es estable en el vacío y no se desintegra espontáneamente. Sin embargo, cuando un antiprotón colisiona con un protón, ambas partículas se transforman en mesones, cuya vida media es extremadamente breve (véase Radiactividad). Si bien la existencia de esta partícula elemental se postuló por primera vez en la década de 1930, el antiprotón no se identificó hasta 1955, en el Laboratorio de Radiación de la Universidad de California, por Emilio Segre y Owen Chamberlain, razón por la cual les fue concedido el Premio Nobel de Física en 1959.